
Международная группа исследователей под руководством Николая Барлева, заведующего Лабораторией клеточного сигналинга Московского физико-технического института, показала принципиальную возможность создания нового класса противоопухолевых препаратов на основе nanoMIP - «пластиковых антител», сообщается в пресс-релизе МФТИ. Эта разновидность наночастиц является полимерным синтетическим аналогом антител и способна специфично связывать белки-мишени на поверхности раковых клеток. В будущем развитие данного подхода может привести к смене существующей парадигмы в разработке новых методов лечения рака. Исследования проводились международной группой ученых из Университета Лестера (Великобритания), Университетского колледжа Лондона (Великобритания), Института цитологии РАН и МФТИ. Работа была опубликована на страницах журнала Nano Letters и была поддержана грантом РНФ.
Основным недостатком большинства методов лечения онкологических заболеваний является их низкая специфичность и связанные с этим побочные эффекты. Наиболее распространённые препараты для химиотерапии поражают абсолютно все делящиеся клетки в организме независимо от их статуса. В то же время с получением новых знаний о молекулярных механизмах рака и наиболее важных участниках этого процесса начали создаваться лекарственные препараты нового поколения, которые нацелены на специфические мишени, отличающие клетки опухоли от нормальных клеток организма. Поскольку раковые клетки быстро делятся, то им постоянно необходимы дополнительные ростовые факторы. Эти факторы, поступающие из окружающей среды, узнаются соответствующими белками-рецепторами на поверхности клеток. Идет активация внутриклеточного сигналинга, который, в свою очередь, тоже направлен на усиление роста раковых клеток.
Оказалось, что такие поверхностные белки-рецепторы часто синтезируются в избыточных количествах в различных формах твердых опухолей. В течение последних двух десятилетий был разработан и успешно прошел клинические испытания целый ряд терапевтических препаратов, направленных как на подавление связывания ростовых факторов с соответствующими рецепторами, так и непосредственно на их ферментативную активность. Соответственно, разработка новых синтетических лекарств против данной группы молекулярных мишеней является перспективным направлением молекулярной фармакологии и привлекает пристальное внимание исследователей во всем мире.
Группа Николая Барлева показала принципиальную возможность создания нового класса противоопухолевых препаратов на основе nanoMIP (molecularly imprinted polymers - полимеров с молекулярными отпечатками). Это полимерный синтетический аналог антител с трехмерной структурой, способной связывать только определенный участок молекулы-мишени, т.е. обеспечивать высокую специфичность взаимодействия. Однако, в отличие от антител, nanoMIP также могут быть использованы в качестве носителя для дополнительных противораковых лекарств. В рамках работы исследователи впервые продемонстрировали возможность синтеза nanoMIP, специфично связывающих аминокислотные последовательности белков-мишеней, а также возможность их использования для направленной доставки лекарственных средств в опухолевые клетки (Рис. 1).
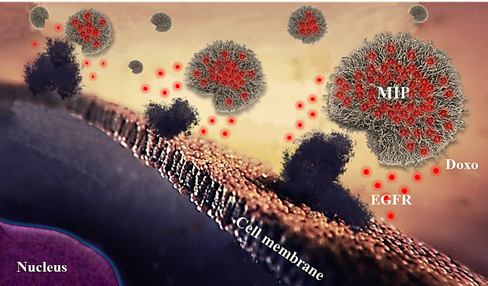
Рис. 1. Схема связывания синтезированных nanoMIP с поверхностью клетки. Полимерные наночастицы специфично связываются с EGFR, в то время как доксорубицин (показан красным) выходит из наночастиц и проникает через клеточную мембрану
Синтез полимерной наночастицы происходит в присутствии молекулы-мишени, что приводит к образованию в nanoMIP "отпечатков" молекулы-мишени. Этот процесс можно сравнить со снятием форм для отливки, при которой конечный материал сохраняет очертания модели. Называется он импритингом. При этом полученные «формы» приобретают способность специфично распознавать и связывать молекулу-«мишень». В проведенном исследовании в качестве мишени был выбран тирозин-киназный рецептор EGFR (epithelial growth factor receptor - рецептор эпидемального фактора роста). Его повышенное присутствие наблюдается в широком спектре опухолей – от колоректального рака, рака легкого, наиболее агрессивной формы рака молочной железы, трижды негативного РМЖ, до опухоли мозга. Именно в силу этих факторов EGFR стал одной из первых мишеней для противоопухолевых препаратов на основе антител. В данной работе наночастицы были получены методом двойного импринтинга против двух молекул мишеней – линейного эпитопа («эпитоп» – участок мишени, который узнаётся антителом при связывании) EGFR и цитотоксического лекарственного препарата доксорубицина. Таким образом, конечный продукт одновременно может связываться с EGFR и оказывать терапевтическое воздействие за счет модификации доксорубицином.
Николай Барлев объясняет: «Несмотря на свою эффективность, препараты на основе антител сложны в разработке и дороги в производстве. В терапии тех форм рака, в которых наблюдается избыточная экспрессия EGFR успешно применяются специфические моноклональные антитела против этой мишени (сетуксимаб, или Erbitux®). Однако, в силу нестабильности этого препарата в организме, пациенту регулярно требуется вводить свежую порцию антител в течение всего курса терапии. Один такой курс для пациента стоит около 100 тысяч долларов США! Синтетические аналоги антител, такие как nanoMIP, лишены этих недостатков, кроме того, в отличие от биомолекул, в целом их стабильность не зависит от таких условий среды как температура и кислотность, а значит шире спектр их возможного использования. В перспективе они могут существенно расширить возможности диагностики и лечения самых разных болезней».
При этом для синтеза nanoMIP, способных специфично распознавать и связывать определенный белок, достаточно создать «отпечаток» не всей молекулы, а лишь ее небольшого участка. Этот короткий олигопептид ковалентно (т.е. с образованием химической связи) «пришивается» на стеклянные шарики, которые затем смешиваются с мономерами акриламида и доксорубицином. Стоит отметить, что полиакриламид, в отличие от собственных мономеров, является биологически безопасным материалом, который используется, например при производстве мягких контактных линз. При увеличении температуры происходит полимеризация мономеров, и формируются наночастицы размером от 100 до 200 нм с молекулярным «отпечатком» белка-мишени и включённым в них доксорубицином. Непрореагировавшие мономеры и неспецифичные наночастицы отмываются, в то время как синтезированные «пластиковые антитела» остаются связанными со стеклянными шариками (Рис. 2).
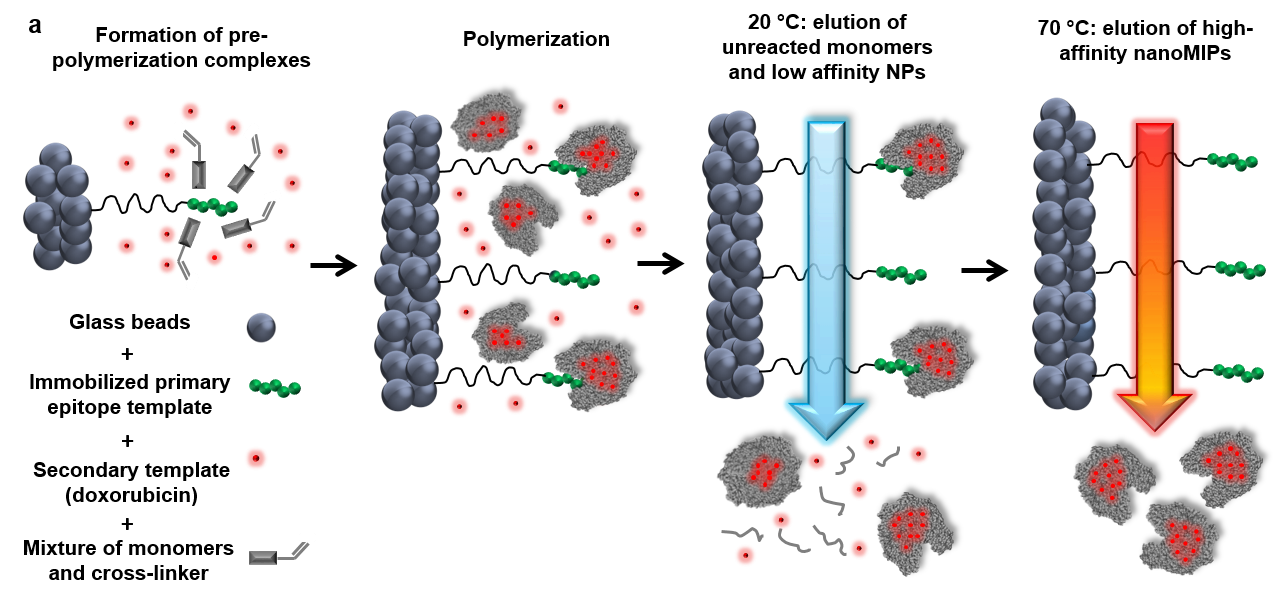
Рис. 2. Схема синтеза nanoMIP с иммобилизованным на стеклянных шариках концевым фрагментом EGFR
«Нам впервые удалось получить полифункциональные nanoMIP, сочетающие в себе специфичность узнавания белков-мишеней, так и возможность адресной доставки различных химических препаратов. Ранее это было невозможно, так как технология синтеза не позволяла стандартизовать условия получения nanoMIP и эффективность получаемого продукта была непредсказуемой. Использование твердофазного синтеза помогло решить эту проблему. На очереди – создание ферромагнитных nanoMIP, которые позволяет еще больше расширить функциональность «пластиковых антител» как для диагностики, так и для терапии различных заболеваний», – говорит Николай Барлев.
В рамках исследования ученые продемонстрировали умеренную и специфичную токсичность полученных наночастиц для раковых клеток. Причем подобная токсичность достигалась исключительно за счет добавления доксорубицина при полимеризации, так как контрольные наночастицы, не несущие противоопухолевый препарат никак не влияли на клетки. Помимо этого, при добавлении терапевтических nanoMIP в клетках наблюдались множественные разрывы ДНК, характерные именно для воздействия доксорубицина (на этом основан механизм его действия). Наконец, связывание «пластиковых антител» с EGFR, дополнительно приводило к уменьшению плотности рецепторов на поверхности клеток.
Таким образом, потенциальный терапевтический эффект разработанных наночастиц для лечения EGFR-зависимых опухолей обусловлен тремя факторами – прямым цитотоксическим эффектом доставляемого противоопухолевого препарата, маскировкой рецептора от его лиганда и уменьшением концентрации EGFR на поверхности клеток. Успешные результаты экспериментов in vitro свидетельствуют о перспективности использования nanoMIP для специфичной доставки лекарств и являются хорошей предпосылкой для дальнейших исследований.
